Гомогенность полученных олигодезоксирибонуклеотидов подтверждали электрофоретически (рис. 10).
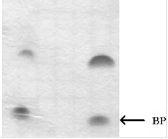
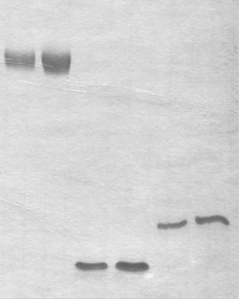
А) ДНК 5'-праймер Б) 3'-праймер
(1) (2) dm 28 dm 28 long (1) (2)
(1) (2) (1) (2)
Рис. 10. Электрофоретический анализ гомогенности: А) оцДНК-библиотеки (ДНК), короткого и удлиненного 5'-праймеров в 15%-ном ПААГ в денатурирующих условиях ((1) - 0.02 о.е., (2) - 0.04 о.е.); Б) 3'-праймера в 12%-ном ПААГ в денатурирующих условиях ((1) - 0.01 о.е., (2) - 0.04 о.е.). Визуализация полос олигонуклеотидов окрашиванием геля “Stains-All”.
На следующем этапе работы на основе оцДНК-библиотеки с помощью фрагмента Кленова ДНК-полимеразы E.coli, 5'-праймеров dm 28 и dm 28 long, было получено 24 мкг короткой дцДНК-библиотеки (дцДНК 1) и 20 мкг удлиненной дцДНК-библиотеки (дцДНК 2).
Для того чтобы проверить, могут ли полученные дцДНК-библиотеки быть субстратом для Т7 РНК-полимеразы, были проведены реакции транскрипции in vitro отдельно для каждой библиотеки с использованием набора для транскрипции “TranscriptAid T7 high yield transcription kit” (Fermentas) (п. 2.3.4.). Использование данного набора позволяет эффективно проводить транскрипцию с коротких дцДНК-матриц. После выделения было получено 0,93 нмоль и 1 нмоль РНК-библиотеки с дцДНК 1 и 2, соответственно (рис. 11).
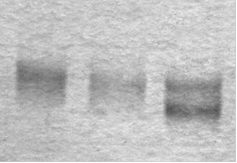
РНК 1 РНК 2 РНКконтроль
Рис. 11. Электрофоретический анализ РНК-транскриптов (РНК 1 и РНК 2) после реакции транскрипции in vitro с дцДНК 1 и 2, соответственно, с помощью “TranscriptAid T7 high yield transcription kit” в 12%-ном ПААГ в денатурирующих условиях. В качестве контроля использовали 71-звенную комбинаторную РНК-библиотеку со случайным районом 40 нт (РНКконтроль), любезно предоставленную А.С. Приваловой.
Таким образом, было показано, что выбранная система оцДНК-библиотеки и праймеров способна реплицироваться посредством фрагмента Кленова; полученные дцДНК-библиотеки являются субстратом для Т7 РНК-полимеразы; длина 5'-участка дцДНК-библиотеки не влияет на количество получаемого транскрипта.
На третьем этапе работы для получения 2'-F-модифицированного транскрипта с использованием Т7 РНК-полимеразы был выбран протокол , разработанный для проведения реакции транскрипции in vitro с использованием 2'-F-модифицированных пиримидинтрифосфатов. В качестве матрицы в реакции транскрипции in vitro была использована дцДНК 2. После выделения была получена 2'-F-модифицированная РНК-библиотека (рис. 12) в количестве 1 нмоль, что соответствует приведенным в протоколе данным. Поэтому далее для получения 2'-F-модифицированного транскрипта мы придерживались протокола
оцДНК дцДНК 2 2'-F-РНК
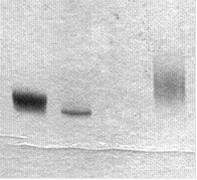
Рис. 12. Электрофоретический анализ РНК-транскрипта (2'-F-РНК) после реакции транскрипции in vitro с использованием дцДНК 2, 2'-F-UTP и 2'-F-CTP по протоколу В качестве контроля использованы оцДНК-библиотека (оцДНК) и дцДНК 2. Электрофорез проведен в 12%-ном ПААГ в денатурирующих условиях.
Таким образом, нами были получены в препаративных количествах праймеры для амплификации комбинаторной библиотеки dm 29, dm 28 и dm 28 long, а также проведен химико-ферментативный синтез 2'-F-модифицированной РНК-библиотеки, что позволило нам перейти к созданию методики отбора 2'-F-модифицированных РНК-аптамеров. Перейти на страницу: 1 2