Васкулярный эндотелиальный фактор роста VEGF в особенности VEGF165 стимулирует ангигиогенез и сосудистую проницаемость (Senger et al., 1983; Keck et al., 1989). За счёт лиганд-рецепторного взаимодействия происходит гомо или гетеро димеризация рецепторов VEGFR1 (также известного как Flk-1)и VEGFR2 (также известного как Flk-1или KDR), которая приводит к автофосфорилированию некоторых тирозиновых аминокислотных остатков цитоплазматического домена. Вдобавок VEGF рецепторы образуют гетеродимеры с семафориновыми рецепторами неофилина (NRP) 1 и 2. NRP рецепторы усиливают, но напрямую не участвуют в VEGF опосредованной сигнализации. Основным рецептором VEGF является VEGFR2, димеризация которого активирует целый ряд внутриклеточных каскадов таких как активация MAPK, фосфатидил-инозитол 3 киназы (Pl3-K), протеин киназы С (PKC), AKTи PLC путей ведущие к усилению пролиферации, миграции, MMP экспрессии, выживаемости и проницаемости эндотелиальных клеток. VEGFR1 выполняет вспомогательную функцию и не участвует в запуски сигнальных каскадов из за низкого уровня автофосфорилирования.
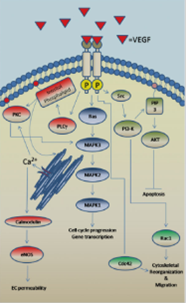
Рис. 5. Инициация VEGF каскада внутриклеточных сигналов (Bonnie, 2009)
Биологическая важность VEGF была продемонстрирована на модельных трансгенных мышах. Исследования показали, что удаление одного из аллелей ген Vegf или аллеля гена рецептора VEGFR-1 (Flt-1) или VEGFR-2 (KDR/Flk-1) приводит к эмбриональной летальности в следствии серьёзных нарушений в развитии сосудов (Fongetal., 1995; Shalabyetal., 1995; Carmelietetal., 1996; Ferraraetal., 1996). Тогда как сверхэкспрессия VEGF приводит к эмбриональной смертности от E12.5-14 в результате дезорганизации кровеносных сосудов, порока сердца и дефектов каронарных сосудов (Miquerol et al., 2000).
Помимо действия на эндотелиальные клетки, VEGF оказывает влияние и на другие типы клеток в зависимости от наличия VEGFR2 и VEGFR1 рецепторов. В почках гломерулогенез и функционирование почечного гломерулярного фильтра находятся под строгим (ген-зависимым) контролем VEGF (Ellen C. Breen, 2007). Последний также участвует в регенерации мышечных клеток, ремоделировании миокарда и эндохондральном костеобразовании, он действует как хемоаттрактант, мобилизующий эндотелиальные клетки костного мозга (Street and Lenehan 2009). На сегодняшний день, описано влияние VEGF на моноциты (Barleon et al., 1996; Clauss et al., 1996), макрофаги (Duyndam et al., 2002), тучные клетки (Norrby, 2002), эозинофилы (Feistritzer et al., 2004), дендритные клетки (Dikov et al., 2005), мегакариоциты (Casella et al., 2003), лимфоциты (Farahani et al., 2005), альвиолярные эпителиальные клетки второго типа (Compernolle V et al 2002) и эпителий хрусталика (Shui YB et al., 2003), гомопоэтические стволовые клетки производные косного мозга циркулирующие в кровотоке (Gerber et al., 2004; Grunewald et al., 2006; Murayama et al., 2002; Iwaguro et al., 2002). VEGFспособствует: выживанию гемопоэтических стволовых клеток, нервных клеток и лимфоцитов, дифференцировке мегакариоцитов и дендритных клеток и участвует в мобилизации клеток предшественников костного мозга. Результаты тромбоцитопении и нейтропении демонстрируют участие VEGFв регуляции уровня пролиферации тромбоцитов и лейкоцитов. VEGF также участвует в лимфоангиогенезе. Помимо его биологического действия на эндотелиальные клетки и клетки иммунной системы появляются новые сведения о его роли в росте и выживаемости нейронов. В статье (Schanzer et al., 2004) было показано, что VEGF действует на стволовые клетки нейронов in vitro и in vivo. В синоптических окончаниях и глиальных клеток экспрессируется рецептор VEGF. Патологически низкий уровень экспрессии VEGF связан с дегенерацией мотонейрона (Oosthuyse et al., 2001).