Получение гибридного белка Trx-hVEGF165
На основании результатов ранее описанного эксперимента по получению hVEGF165 с помощью «стоп старт» конструкции было решено осуществить получение hVEGF165 в виде химерного белка. Так как уровень продукции тиоредоксина, несмотря на низкий выход hVEGF165, был, достаточно, высокий.
В качестве экспрессионного вектора решили выбрать ранее полученный в лаборатории вектор pTVG производный вектора pET32 b(+). Вектор pTVG содержит ген тиоредоксина, последовательность кодирующую сайт TEV протеазы и удобный полилинкер. Ген hVEGF165 был клонирован в плазмиду pTVG по сайтам Xho I и Nco I. В результате получили плазмиду pTVG-VEGF165 (Рис. 16). В качестве штамма носителя взяли E. coli Origami (DE3).
За счёт делеций гена глутатион редуктазы (gor522) и тиоредоксин редуктазы (trxB) биосинтез hVEGF165 в штамме Origami (DE3) идёт с образованием внутри и межмолекуляных дисульфидных мостиков стабилизирующих молекулу белка и способствующие правильному фолдированию молекулы.
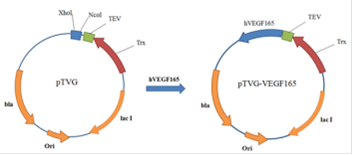
Рис. 16. Схема клонирования hVEGF165 в pTVG
Данной плазмидой трансформировали клетки Origami (DE3) и осуществили наработку биомассы Origami (DE3)/pTVG-hVEGF165. Полученную биомассу дезинтегрировали с помощью ультразвукового дезинтегратора. Осветленный лизат хроматографировали на колонке HiTrap Heparin Sepharose. За счёт наличия на С конце молекулы VEGF165 25 аминокислотных остатка, несущих сайты аффиности к гепарину (N. Ferrara, 2010) было решено фракционировать белки осветленного клеточного лизата на гепарин сефарозе.
Фракции анализировали методом ПААГ электрофореза в денатурирующих условиях. Объединяли фракции, в которых содержание ГБ превышало 90%. Фракции, содержащие ГБ концентрировали методом ультрафильтрации на мембране YM 30. К концентрату, содержащему гибридный белок, была добавленная TEV протеаза в соотношении субстрат - фермент 100:1 соответственно. Протеолитическое расщепление было не значительным, менее 40% (Рис. 17.).
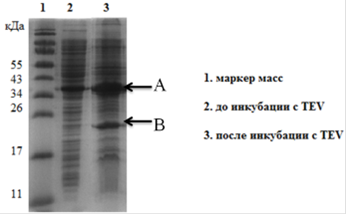
Рис. 17. Электрофореграмма (15% SDS-ПААГ). Результаты протеолитического расщепления ГБ TEV протеазой. Где A- гибридный белок (Trx-hVEGF165), B-тиоредоксин.
Вероятной причиной низкого уровня протеолитического расщепления были неспецифические взаимодействия hVEGF165 с тиоредоксином, экранировавшие сайт TEV.
Таблица 2
Содержание полипептидных продуктов на всех стадиях выделения и очистки рекомбинантного белка hVEGF165 из биомассы Origami (DE3)/pTVG-hVEGF165
| Этапы очистки | Общий белок (мг) | Содержание ГБ (%) | Содержание hVEGF165 (%) |
| Осветлённый клеточный лизат | 117 | 15 | |
| Аффинная хроматография на колонке HiTrap Heparin Sepharose | 14.8 | 90 | |
| Расщепление ГБ TEV протеазой | 14.8 | 34 |
Получение гибридного белка CBD-hVEGF165
Высокий уровень экспрессии гибридного белка Trx-hVEGF165 подтвердил правильность выбранного способа продукции целевого белка. Однако, трудности возникшие на стадии сайт специфичного протеолитического расщепления TEV протеазой были, скорей всего, вызваны специфической природой тиоредоксина, влияющего на фолдинг молекулы гибридного белка. В результате снижалась доступность сайта TEV для TEV протеазы. Поэтому мы решили использовать в качестве лидерного полипептида белок с принципиально другой структурой, а также обладающего небольшой молекулярной массой в сравнении с молекулой тиоредоксина. Таким образом, было решено создать конструкцию, содержащую на N конце хитинсвязывающий домен (CBD) соединённый с hVEGF165 через сайт TEV.
CBD фрагмент амплифицировали с pTWIN1 с помощью праймеров Т7-prim и CBD2, содержащими сайты рестриктаз Xba I и Bgl II соответственно. В качестве вектора была выбрана плазмида pET-32b(+). Данный вектор содержит в полилинкерной последовательности сайты рестрикции Xba I и Bgl II (Рис. 19), по которым и была произведена вставка амплифицированного фрагмента с учетом корректной рамки считывания (Рис. 18). Перейти на страницу: 1 2 3 4 5