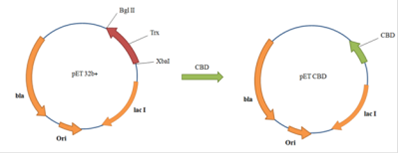
Рис. 18. Схема получения плазмиды pET-CBD
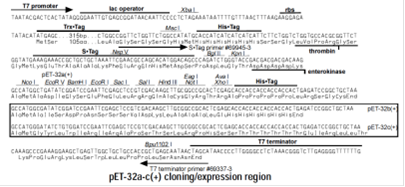
Рис. 19. Полилинкерная последовательность вектора pET-32b(+).
Полученной лигазной смесью трансформировали компетентные клетки Е.coli ER2566. Суспензию трансформированных клеток рассевали на чашки с селективной средой. Клоны, полученные при высевании трансформированных клеток на агаризованную среду пересевали в жидкую среду с добавлением ампициллина для выращивания и отбора клонов.
Отбор клонов осуществляли по результатам данный полученных при электрофорезе клеточных лизатов клонов в ПААГ. (Рис. 20).
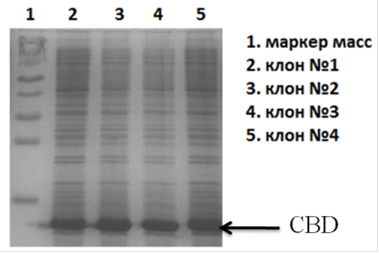
Рис. 20. Электрофореграмма (15% SDS-ПААГ) суммарных клеточных лизатов клонов E. coli ER2566/ pET-CBD
Из отобранных клонов выделили плазмидную ДНК для дальнейшей работы.
Получение экспрессионного вектора pCBD-VEGF165.
Ранее полученный ген человеческого VEGF165 был амплифицирован при помощи полимеразной цепной реакции (ПЦР) с праймерами, содержащими сайты эндонуклеаз рестрикции Bgl II и Xho I, в качестве матрицы использовали плазмиду pTVG-VEGF165.
Амплифицированый ген hVEGF165 был клонирован по сайтам Xho I и Bgl II в ранее созданную для этого генетическую конструкцию pET-CBD. В результате получили плазмиду pCBD-VEGF165 (Рис. 21).
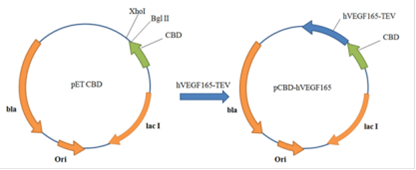
Рис. 21. Схема получения плазмиды pCBD-hVEGF165
Полученной лигазной смесью трансформировали компетентные клетки E. coli ER 2566, которые затем рассеивали на твёрдой питательной среде, с целью отбора клонов. В результате было проверенно 9 клонов на наличие экспрессии гибридного белка (Рис. 22).
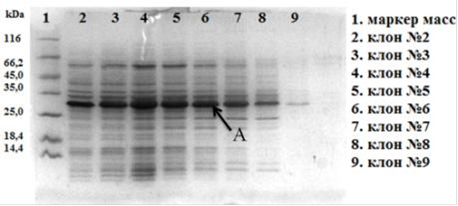
Рис. 22. Электрофореграмма (15% SDS-ПААГ) суммарных клеточных лизатов клонов E. coli ER2566/pCBD-hVEGF165. Где А - гибридный белок CBD-hVEGF165
Для подтверждения строения вставки гена рекомбинантного белка, полученные плазмиды были просеквенированы (в компании Евроген).
Из биомассы клона №4 была выделена плазмида pCBD-VEGF165 для дальнейшей работы.
Получение штамма продуцента гибридного белка CBD-VEGF165
Выделенной плазмидой pCBD-VEGF165 трансформировали клетки E. coli Origami (DE3). Полученный штамм продуцент проверяли на наличие продукции гибридного белка. Элетрофорез проводили в восстанавливающих и в невосстанавливающих условиях с целью обнаружения димера гибридного белка. Электрофореграмма в невосстанавливающих условиях показала наличие димера химерного белка (Рис. 23). Целевой белок после ультразвуковой дезинтеграции биомассы клетки E. coli Origami (DE3)/pCBD-VEGF165 в основном присутствовал в растворённой фракции. Таким образом, нам удалось избежать образования телец включения, характерных для гетерологической экспрессии многих белков в клетках E. coli.
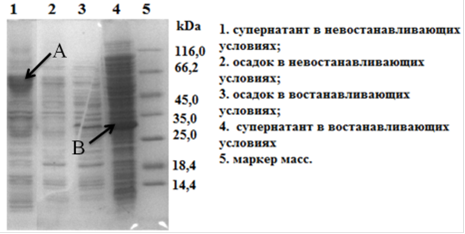
Рис. 23.Электрофореграмма (15% SDS-ПААГ) в восстанавливающих и невостанавливающих условиях. Где A- димер гибридного белка CBD-hVEGF165, B- мономер гибридного белка CBD-hVEGF165.
Подбор условий культивирования штамма E. coli Origami (DE3)/pCBD-VEGF165
В ходе дальнейшей работы был проведен подбор оптимальных условий культивирования штамма-продуцента. Для этого в процессе культивирования клеток после добавления ИПТГ каждый час отбирались пробы биомассы. Культивирование проводили при 30о С.
Результаты данного эксперимента представлены на рис. 24.
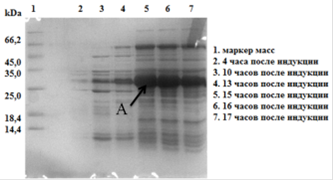
Рис. 24. Электрофореграмма (15% SDS-ПААГ) образцов биомассы E. coli Origami (DE3)/pCBD-hVEGF165после индукции ИПТГ. Где А - гибридный белок CBD-VEGF165.
Из полученной электрофореграммы видно, что оптимальное время культивирования клеточной культуры E. coli Origami (DE3)/pCBD-VEGF165 15-16 часов после добавления ИПТГ.
Выделение и очистка гибридного белка CBD-hVEGF165.
Полученный продуцент E.coli Origami (DE3)/pCBD-VEGF165 культивировали при 37 0С до оптической плотности 0,6-0,7, затем добавляли ИПТГ и выращивали при 30 0С в течение 16 часов.
Биомассу штамма-продуцента E.coli Origami (DE3)/pCBD-VEGF165 подвергали ультразвуковой дезинтеграции в буфере, содержащем 2 М мочевину. Центрифугированием отделили растворимую фракцию, содержащую гибридный белок, от нерастворимого осадка. Используя сродство VEGF165 к гепарину, гибридный белок, содержащийся в осветлённом лизате, очищали от белков E. coli на колонке HiTrap HP Heparin-Sepharose. Полученные фракции анализировали на наличие димера гибридного белка с помощью SDS-ПААГ электрофореза в невосстанавливающих условиях. Перейти на страницу: 1 2 3 4 5